Gazette • articles à enrichir
Que pensez-vous de Vikidia ? Venez mettre un message sur le livre d'or !
« Atome » : différence entre les versions
m (Révocation des modifications de 204.101.128.2 (discussions) ; retour à la version de Flodelaplage (discussions)) |
(→Taille) |
||
| Ligne 7 : | Ligne 7 : | ||
==Taille== | ==Taille== | ||
Les atomes sont | Les atomes sont gros comme des penis: le point à la fin de cette phrase est ''large'' d'une vingtaine de millions ({{formatnum:20000000}}) d'atomes. La taille caractéristique d'un atome est de 10<sup>-7</sup> [[millimètre]]s<ref>10<sup>-7</sup> se lit {{"|10 [[puissance (mathématiques)|puissance]] -7}} et équivaut à : 1/10<sup>7</sup>, c'est-à-dire 0,0000001.</ref>. Cette distance s'appelle l'[[angstrom]]. | ||
La taille d'un atome est très petite ; la taille de son noyau est encore largement plus petite. En comparaison avec le rayon du noyau, la distance entre le noyau et les électrons est très grande. Il n'y a rien entre cela, que du vide. C'est pour cela qu'on dit que la matière est composée principalement de [[vide]]. Un atome est constitué de plus de 99,9% de vide. | La taille d'un atome est très petite ; la taille de son noyau est encore largement plus petite. En comparaison avec le rayon du noyau, la distance entre le noyau et les électrons est très grande. Il n'y a rien entre cela, que du vide. C'est pour cela qu'on dit que la matière est composée principalement de [[vide]]. Un atome est constitué de plus de 99,9% de vide. | ||
Version du 13 décembre 2010 à 17:38
|
|
Il existe un quiz sur les atomes.
|
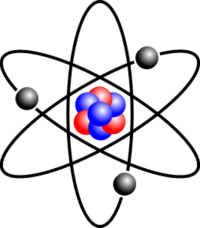
Un atome est une toute petite partie de la matière, une sorte de « brique » qui la constitue. Un atome contient un noyau (ensemble de protons et de neutrons), et autour de ce noyau, il y a des électrons. On distingue ces particules du fait qu'elles comportent des « charges » différentes : les neutrons n'ont aucune charge, les protons ont une charge positive, et les électrons une charge négative. Les différents atomes sont classifiés selon le nombre de protons et de neutrons dans le noyau.
La matière (cet ordinateur, le corps humain, la Terre...) est constituée d'atomes ! Quelques atomes reliés dans un ordre précis constituent une molécule. La chimie est la discipline scientifique qui étudie comment les atomes s'assemblent pour former ces molécules. Plusieurs molécules côte à côte vont donner la matière, et selon qu'elles sont proches ou éloignées, ce sera un solide, un liquide ou un gaz.
Taille
Les atomes sont gros comme des penis: le point à la fin de cette phrase est large d'une vingtaine de millions (20 000 000) d'atomes. La taille caractéristique d'un atome est de 10-7 millimètres1. Cette distance s'appelle l'angstrom.
La taille d'un atome est très petite ; la taille de son noyau est encore largement plus petite. En comparaison avec le rayon du noyau, la distance entre le noyau et les électrons est très grande. Il n'y a rien entre cela, que du vide. C'est pour cela qu'on dit que la matière est composée principalement de vide. Un atome est constitué de plus de 99,9% de vide.
- Peut-on voir un atome ?
Certainement pas à l'œil nu ! Les microscopes sont des appareils qui permettent de regarder ce qui est très petit. Mais en réalité, on détecte les effets de la présence d'un atome. Pour cela, il faut développer une physique suffisamment développée, qui étudie les propriétés de l'atome et de ses constituants : la mécanique quantique.
Il existe un cas où on peut « voir » les atomes (les électrons en fait) : lorsqu'on observe un cristal aux rayons X. Dans un cristal, tout est très ordonné et les atomes se trouvent cycliquement au même endroit. Un motif d'un cristal est répété presque à l'infini. Chaque électron de chaque atome d'un motif chaque va émettre un peu de « lumière » dans une direction donnée, toujours la même puisque les motifs du cristal sont répétés. La somme de toutes ces petites contributions permet de voir un électron (on obtient un diagramme de diffraction). Mais cela n'est possible que dans un cristal, qui est un solide très ordonné. Ensuite, une analyse mathématique du diagramme de diffraction permet de reconstituer un motif du cristal et on a donc bien vu les atomes !
Histoire
La notion d'atome date de la Grèce antique. Un philosophe, Démocrite, a imaginé qu'on pouvait couper une orange en deux, puis encore en deux, puis encore en deux, etc., jusqu'à ce qu'on ne puisse plus couper en deux : on arrive à l'atome, qui est le mot grec qui signifie qui ne peut plus être coupé. Cette intuition géniale va ensuite rester en sommeil pendant très longtemps. Ce n'est qu'au XVIIe siècle que la notion sera reprise et rendue scientifique par les savants de l'époque, comme Lavoisier. Ainsi pouvait naître la chimie, qui décrit comment les atomes s'unissent entre eux et dans quelles proportions pour former des molécules.
Structure
Un atome est constitué d'un nuage électronique tournant autour d'un noyau. Le nuage électronique est constitué d'électrons. Le noyau est constitué de nucléons. Il y a deux sortes de nucléons : les protons et les électrons. Les protons ont une charge positive, et les électrons une charge négative.
Les électrons ont une masse très faible, environ 2 000 fois plus petite que celle d'un proton. Toute la masse d'un atome est donc concentrée dans son noyau. Un proton pèse 1 unité et un neutron pèse 1 unité, l'électron ne pèse lui qu'environ un millième d'unité. Donc pour connaître la masse d'un atome, il suffit d'additionner le nombre de protons et le nombre de neutrons et on peut négliger la masse des électrons.
Les physiciens se sont un jour demandé : de quoi est constitué l'atome ? Pour répondre à cette question, ils ont fait se rencontrer à des très grandes vitesses, proche de celle de la lumière, divers atomes (dans un accélérateur de particule) et ils ont pu casser des noyaux. Les images obtenues à l'aide de ces collisions leur ont permis de découvrir des particules nouvelles, comme les quarks et les gluons, qui sont les composants des protons et des neutrons. L'atome n'est pas la plus petite brique constitutive de la matière.
Classement
Les atomes sont classés dans un tableau périodique des éléments, créé par Mendeleïev, selon leur ordre croissant de masse atomique. L'élément le plus léger est l'atome d'hydrogène, son noyau est composé d'un proton et il possède un électron. L'élément naturel le plus lourd est le plutonium, dont le noyau est composé de 94 protons et 145 neutrons, autour duquel se trouvent 94 électrons.
Note
| Article mis en lumière la semaine du 8 novembre 2009. |
| Portail des sciences — Tous les articles sur la physique, la chimie et les grands scientifiques. |