Règle de l'octet
La loi de l'octet en chimie (ou règle de l'octet) est une loi qui va permettre de prévoir le comportement des réactions chimiques. En effet, pourquoi un atome forme-t-il une molécule avec tel atome bien précis et pas un autre ? Justement, c'est à cela que sert la loi de l'octet ...
Le nuage d'électrons[modifier | modifier le wikicode]
Tout d'abord, quelques rappels: L'atome est composé d'un noyau et d'un nuage électronique. Le noyau est lui-même constitué de protons et de neutrons, tandis que le nuage électronique est composé d'électrons tournant "en orbite" autour du noyau.
Pour pouvoir comprendre la loi de l'octet, il faut connaitre la représentation atomique de Bohr. Dans ce type de représentation, on voit le noyau au milieu, et autour des cercles, ou si vous préférez des "ceintures" qui entourent le noyau.
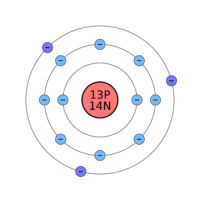
Voici par exemple l'atome d'aluminium dessiné suivant le modèle atomique de Bohr :
Comme on peu le voir, il y a au milieu un cercle rouge, qui représente le noyau. Autour, on voit trois cercles, représentant les couches d'électrons (les électrons sont représentés ici par de petites boules bleues avec un "-" à l'intérieur).
Mais, les électrons se disposent-ils au hasard sur ces "orbites" ?
Certainement pas ! En fait, les électrons se répartissent de manière très précise autour du noyau.
Comme on le montre le modèle atomique de Bohr, il peut y avoir de 1 à 7 couches d'électrons autour du noyau (chaque couche est représentée par une lettre).
Voici les caractéristiques de ces couches:
- K = couche 1 : 2 électrons maximum.
- L = couche 2 : 8 électrons maximum.
- M, N, O, P et Q sont respectivement les couches 3, 4, 5, 6 et 7.
Elle ne contiennent jamais plus de 32 électrons.
Ces caractéristiques limitent les possibilités de répartitions, mais ne suffisent pas à connaitre la configuration électronique exacte. En effet, voici par exemple la configuration électronique de l'atome de manganèse (Mn) :
- K (couche 1) = 2
- L (couche 2) = 8
- M (couche 3) = 18
- N (couche 4) = 32
Comme on le voit, la couche N (couche 4) contient 32 électrons, alors que la couche précédente n'en contient que 18 ! C'est pour cela que dans le tableau périodique des éléments, on peut voir une formule le plus souvent très ardue. C'est justement cette formule qui permet de connaître la configuration électronique exacte de l'atome.
Note:
En règle générale, la couche M (troisième couche) ne se remplit pas tant que la couche précédente n'est pas au complet.
La loi de l'octet[modifier | modifier le wikicode]
Durant une réaction chimique, un atome cherche toujours à trouver un "équilibre". Et pour réaliser cet équilibre, il faut que sa couche externe contienne exactement 8 électrons. Une fois cette configuration acquise, le nuage électronique de l'ion formé devrait être le même que celui du gaz noble suivant ou précédant l'élément.
C'est pourquoi les atomes de la famille I, II et III chercheront à perdre 1, 2 ou 3 électrons. Les atomes de cette famille ne comportant pas plus de p électrons sur leur couche externe, cette dernière couche va donc disparaître, laissant apparaître la couche inférieure qui contient généralement 8 électrons. La configuration électronique formera sera alors la même que le gaz noble précédent.
Les atomes des familles VI, VII et VIII vont quant à eux chercher à gagner 1, 2 ou 3 électrons. En effet, la couche externe de ces atomes ne comporte pas plus de 5 électrons. C'est pourquoi, en gagnant 1, 2 ou 3 électrons, l'atome réalisera la loi de l'octet, et aura la même configuration électronique que le gaz noble suivant.
Exemple : Le Fluorure de Sodium[modifier | modifier le wikicode]
Prenons par exemple le Fluor. En observant le tableau périodique des éléments, on trouve le Fluor dans l'avant dernière colonne, c'est-à-dire dans la famille VII (famille des halogènes). Comme le montre le schéma ci-contre, l'atome de Fluor a 2 électrons sur sa couche K (couche n°1), et 7 sur sa couche L (couche n°2). Or, pour obtenir le maximum de stabilité, sa couche externe doit réaliser la loi de l'octet, c'est-à-dire avoir 8 électrons. Puisqu'il en a déjà 7, il ne lui en manque plus qu'un.
C'est pourquoi, on peut prévoir certaines caractéristiques d'une réaction chimique contenant du Fluor. Par exemple, si l'on fait réagir du Fluor et du Sodium, le Fluor va gagner un électron, qu'il prendra au Sodium. Le Sodium quant à lui ne demande pas mieux que de "donner" un de ses électrons, car en perdant un électron, il va ainsi réaliser la configuration de l'octet. Cette réaction va donc donner du Fluorure de Sodium, qui est un élément très stable (plus précisément, c'est un cristal ionique).
Autres facteurs[modifier | modifier le wikicode]
Grâce à cela, on peut prévoir en partie le comportement des atomes. Néanmoins, beaucoup d'autres facteurs sont à prendre en compte.
Parmi eux, il faut surtout retenir :
- La différence entre l'électronégativité des réactifs.
- Les effets de l'affinité électronique.
- Les exceptions, tels que l'hydrogène et le carbone, et les atomes dont le nombre d'électrons est inférieur à 4 (Z<4) voir la note.
- Les propriétés de certaines familles.
Par exemple les alcalino-terreux sont très instables, tandis que les gaz nobles sont plutôt neutres (car il ont 8 électrons sur leur couche externe).
Note :
En chimie, on appelle le nombre d'électrons d'un atome le "nombre atomique Z". Ainsi, Z<4 signifie que le nombre d’électrons de l'atome est inférieur à 4.
|
|